
衰老,是一个复杂、多阶段、渐进的过程,发生在生命的整个过程。随着年龄的增加,人体的器官、肌肉会逐渐衰老,一些疾病也伴随着年龄的增长而发生,包括癌症、糖尿病、心血管疾病等。
雷帕霉素蛋白(mTOR)复合物,是人体多种功能的关键因子,细胞代谢的关键参与者。模型生物中的遗传和药理学研究显示,通过作用于少量蛋白质的功能,可以调节衰老过程,缩短或延长寿命,其中包括对mTOR复合物1(mTORC1)的机制靶点的抑制。
mTOR蛋白复合物的活性受细胞内营养物质的量调节,细胞内部不断有化学信号进出,这些信号通过蛋白质或细胞间通讯传递,mTOR蛋白复合物是参与利用能量的大型细胞通讯高速公路中的关键因子--细胞代谢。
2024年6月7日,西班牙国家癌症研究中心的研究人员在" Nature Aging "期刊上发表了一篇题为" A mild increase in nutrient signaling to mTORC1 in mice leads to parenchymal damage,myeloid inflammation and shortened lifespan "的研究论文。
该研究显示,在小鼠模型中,增加细胞的营养信号,会导致实质损伤、炎症和寿命缩短。当增加mTOR活性时,会促进小鼠炎症分子表达,促进衰老,小鼠寿命缩短约20%。而阻断引起炎症的免疫反应,可以改善衰老的症状。这一过程也适用于人类。

在这项研究中,研究人员为了调控mTOR的活性,着手于发送信号指示细胞中可用营养物质数量的蛋白质,对这种蛋白质进行了基因改造,使其向mTOR发送假信号,让mTOR感觉到营养过剩。
当mTOR通路被激活时,犹如小鼠吃得更多一样,尽管实际上它们的饮食并没有变化。
结果发现,当携带基因改造的小鼠成年时,小鼠的细胞开始出现功能障碍,出现衰老的典型症状。
具体来说,小鼠皮肤变薄、炎症增加、骨矿物质密度降低、收缩压和舒张压升高,SA-β-半乳糖苷酶显著增加,衰老相关分泌表型(SASP)的表达也持续增加,胰腺、肝脏和肾脏等重要器官受到损伤。
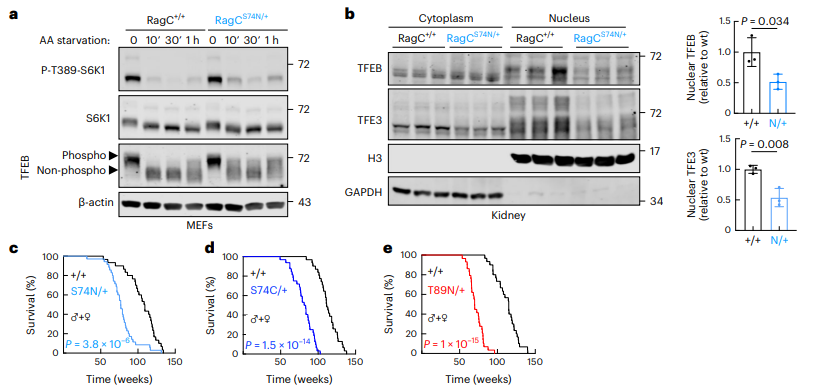
此外,由于损伤严重,免疫系统无法承受如此巨大的损伤,会导致损伤积累,从而引发炎症,进一步加剧这些器官损伤。
最终,导致小鼠的寿命缩短20%,对于人类而言,相当于少活16年。
研究人员还分析了两个小鼠队列和西班牙百岁老人研究人类队列,发现这一结果也适用于人类,当细胞感知营养过剩时,就会促进衰老,例如溶酶体的活性降低,而溶酶体活性的降低也发生在人类衰老过程中。
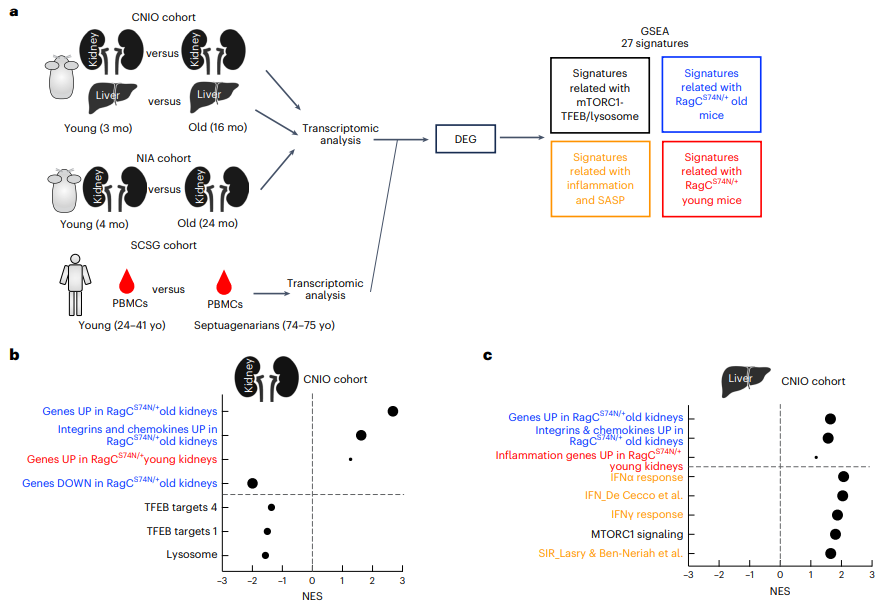
重要的是,当研究人员阻断了引起炎症的免疫反应,可以改善衰老的症状,器官的损伤得到改善,从而延长了小鼠的寿命。
研究人员表示,虽然这项研究是在动物模型中进行的,但这一分子过程与人类一致,结果可以推断到人类衰老。这项研究还揭示了为什么热量限制可以延长寿命,因为限制营养摄入激活的某些基因与mTOR相互作用。
综上,结果表明,细胞感知营养过剩,也就是mTOR蛋白复合物活性增加,会促进衰老,导致实质损伤、炎症和寿命缩短。而阻断引起炎症的免疫反应,可以改善衰老的症状,表明控制慢性炎症可作为健康衰老的潜在治疗。
